ÉTER
Éter é todo composto orgânico onde a acadeia carbônica apresenta – O
– entre dois carbonos. O oxigênio deve estar ligado diretamente a dois
radicais orgâncios (alquila ou arila). A fórmula genérica do éter é R – O – R, onde o R é o radical e o O é o oxigênio.
Veja alguns exemplos:
Utilidade
O éter mais conhecido é o éter comum, ou etóxietano ou ainda éter dietílico. Ele é encontrado em farmácia e hospitais. É um líquido muito volátil, com ponto de ebulição em torno de 35°C, muito inflamável, incolor e com odor característico. Pode ser utiizado como solvente de graxas, óleos, resinas e tintas.
Passou a ser usado, como anestésico por inalação, em 1842. Provocava grande mal estar nos pacientes após a anestesia e foi então substuído por outros anestésicos.
Éter comum CH3 – CH2 – O – CH2 – CH3

Pintura da primeira demostração de cirurgia com anestesia com éter, nos EUA, em 1842.

O nome oficial dos éteres, ou nomenclatura IUPAC, contém a palavra ÓXI entre o nome dos dois grupos. O primeiro nome deve ficar com o prefixo do menor número de carbonos. E o último nome com o nome do hidrocarboneto que contém o maior número de carbonos.
Grupo menor + óxi – grupo maior
Exemplos:
metóxi-benzeno
















 eph Gay-Lussac
( 1778 - 1850 ), foi um dos primeiros astronautas efetuando assim
importantes observações estipulando que um gás se expande
proporcionalmente a sua temperatura absoluta se for mantida constante a
pressão de caráter científico. Logo em seguida foi descoberta a vacina
contra a raiva pelo Químico e biólogo francês Louis Pasteur
(1822 - 1895), que também realizou pesquisas notáveis de
estereoquímica. Estudou a doença dos bichos da seda, elaborou um método
de conservação da cerveja, a pasteurização. Mostrou que o carbúnculo era
causado por um micróbio, descobriu o vibrião séptico. Os elementos
químicos da tabela periódica foram descobertos pelo químico siberiano Dimitri Ivanovitch Mendeleev
(1834 - 1907 ), que se especializou em pesquisas sobre a natureza e a
origem do petróleo Russo. Em sua homenagem, ao elemento químico da
tabela periódica 101 foi dado o nome de mendelévio. Destacou-se também
na ciência química o considerado maior químico americano Gilbert Lewis
( 1875 - 1946 ), o qual estudava as estrutura moleculares e a
termodinâmica, o conceito de ligação covalente foi talvez aquele que
mais trouxe frutuosas consequências em toda a química, em especial na
química orgânica.
eph Gay-Lussac
( 1778 - 1850 ), foi um dos primeiros astronautas efetuando assim
importantes observações estipulando que um gás se expande
proporcionalmente a sua temperatura absoluta se for mantida constante a
pressão de caráter científico. Logo em seguida foi descoberta a vacina
contra a raiva pelo Químico e biólogo francês Louis Pasteur
(1822 - 1895), que também realizou pesquisas notáveis de
estereoquímica. Estudou a doença dos bichos da seda, elaborou um método
de conservação da cerveja, a pasteurização. Mostrou que o carbúnculo era
causado por um micróbio, descobriu o vibrião séptico. Os elementos
químicos da tabela periódica foram descobertos pelo químico siberiano Dimitri Ivanovitch Mendeleev
(1834 - 1907 ), que se especializou em pesquisas sobre a natureza e a
origem do petróleo Russo. Em sua homenagem, ao elemento químico da
tabela periódica 101 foi dado o nome de mendelévio. Destacou-se também
na ciência química o considerado maior químico americano Gilbert Lewis
( 1875 - 1946 ), o qual estudava as estrutura moleculares e a
termodinâmica, o conceito de ligação covalente foi talvez aquele que
mais trouxe frutuosas consequências em toda a química, em especial na
química orgânica.

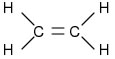



.jpg)

